De fascinerende wereld van atoomgroottes in d-blok elementen
Wat bepaalt de eigenschappen van een element? Een cruciale factor is de atoomgrootte. Bij de d-blok elementen, de metalen in het midden van het periodiek systeem, zien we fascinerende trends en afwijkingen in atomaire radii. Deze subtiele verschillen beïnvloeden hun chemisch gedrag en maken ze onmisbaar in talloze toepassingen.
De atoomgrootte van d-blok elementen, ook wel atomaire straal genoemd, verwijst naar de afstand tussen de kern en de buitenste elektronenschil. Deze grootte is niet constant binnen de d-blok elementen, maar varieert afhankelijk van de periode en groep waarin het element zich bevindt. Het begrijpen van deze variaties is essentieel voor het voorspellen van de chemische reactiviteit en fysische eigenschappen van deze metalen.
De studie van atoomgroottes in d-blok elementen is historisch gezien belangrijk geweest voor de ontwikkeling van de chemie. Vroege chemici observeerden verschillen in reactiviteit en eigenschappen, wat leidde tot de ontwikkeling van het periodiek systeem en het concept van atomaire structuur. De atoomgrootte speelt een centrale rol in het verklaren van periodiek terugkerende trends.
De atoomstralen van d-blok elementen worden beïnvloed door verschillende factoren, waaronder de kernlading, het aantal elektronenschillen en de afscherming door binnenste elektronen. De toenemende kernlading over een periode trekt de elektronen sterker aan, wat leidt tot een afname van de atoomgrootte. Echter, de afscherming door binnenste elektronen vermindert de effectieve kernlading die de buitenste elektronen ervaren, wat de trend complexer maakt.
Een belangrijk aspect van de atoomgrootte van d-blok elementen is de lanthanidecontractie. Dit fenomeen beschrijft de afname in atoomgrootte over de lanthanidenreeks, die de atoomstralen van de elementen die eronder in het periodiek systeem staan beïnvloedt. Dit heeft gevolgen voor de chemische eigenschappen van elementen zoals hafnium en zirkonium.
De atomaire straal beïnvloedt diverse eigenschappen, zoals de ionisatie-energie, elektronegativiteit en de vorming van chemische bindingen. Een grotere atoomgrootte leidt over het algemeen tot een lagere ionisatie-energie, omdat de buitenste elektronen minder sterk gebonden zijn aan de kern.
Voor- en nadelen van kennis over atoomgrootes in d-blok elementen
Het is belangrijk om de voordelen en nadelen te begrijpen van het bestuderen van atoomgroottes:
Voordelen: Begrip van chemische reactiviteit, voorspelling van materiaaleigenschappen, ontwikkeling van nieuwe materialen. Nadelen: Complexe interacties tussen factoren, geen absolute voorspellingen mogelijk.
Veelgestelde vragen:
1. Wat is de trend in atoomgrootte over een periode in de d-blok elementen? Over het algemeen neemt de atoomgrootte af.
2. Wat is de lanthanidecontractie? De afname in atoomgrootte over de lanthanidenreeks.
3. Hoe beïnvloedt de atoomgrootte de ionisatie-energie? Een grotere atoomgrootte leidt tot een lagere ionisatie-energie.
4. Waarom zijn d-blok elementen vaak goede katalysatoren? Vanwege hun variabele oxidatietoestanden en vermogen om complexen te vormen.
5. Wat is het verband tussen atoomgrootte en metaalbinding? De atoomgrootte beïnvloedt de sterkte van de metaalbinding.
6. Hoe beïnvloedt de atoomgrootte de vorming van legeringen? De atoomgrootte bepaalt de mate waarin elementen in elkaar kunnen oplossen.
7. Wat is het belang van atoomgrootte in de nanotechnologie? De atoomgrootte is cruciaal voor het manipuleren van materialen op nanoschaal.
8. Waar kan ik meer informatie vinden over atoomgrootes van d-blok elementen? Chemieboeken en online bronnen zoals Chemguide en Wikipedia.
Tips en Trucs: Visualiseer de trends in het periodiek systeem. Vergelijk de atoomstralen van elementen binnen dezelfde groep en periode.
De atoomgrootte van d-blok elementen is een fundamentele eigenschap die hun chemisch gedrag en fysische eigenschappen beïnvloedt. Het begrijpen van de trends en invloeden op de atomaire straal is essentieel voor chemici, materiaalkundigen en iedereen die werkt met deze veelzijdige metalen. Door de atomaire structuur te doorgronden, kunnen we nieuwe materialen ontwikkelen, chemische reacties optimaliseren en de wereld om ons heen beter begrijpen. De studie van atoomgroottes opent de deur naar talloze innovaties en technologische vooruitgang, van efficiëntere katalysatoren tot geavanceerde materialen met ongekende eigenschappen. Verder onderzoek naar dit fascinerende gebied zal ongetwijfeld leiden tot nieuwe ontdekkingen en toepassingen in de toekomst.
Online puzzel prijsvragen winnen
Woorden met c ontdek de kracht van de c
De x factor bijzondere jongensnamen met een x

General Properties of the Transition Elements d | Innovate Stamford Now

D Block Elements IIT JEE Study Material with Properties and Examples 2022 | Innovate Stamford Now

Periodic Table D Block Elements Names | Innovate Stamford Now

atomic size of d block elements | Innovate Stamford Now

D Block Elements IIT JEE Study Material with Properties and Examples | Innovate Stamford Now

Electron Configuration Periodic Table Elements Chemistry 49 OFF | Innovate Stamford Now

D Block Elements IIT JEE Study Material with Properties and Examples | Innovate Stamford Now

Explain the trends in atomic radii of d block elements OR Explain the | Innovate Stamford Now

atomic size of d block elements | Innovate Stamford Now

Propriétés des métaux de transition Chimie illimitée | Innovate Stamford Now
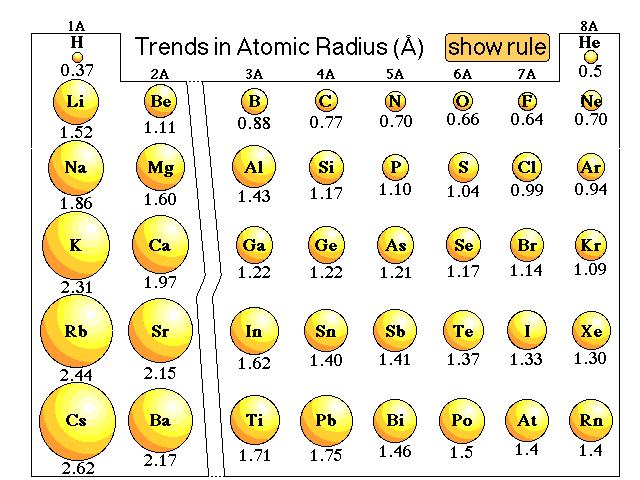
Atomic Radius Trend Chart | Innovate Stamford Now

Periodic table of the elements colored according to their block s p | Innovate Stamford Now

Share 68 kuva d block s te fan twilight zone | Innovate Stamford Now

Particle Diagram Of An Element | Innovate Stamford Now

atomic size of d block elements | Innovate Stamford Now